Giải bài 12 hóa học 10: Liên kết ion Tinh thể ion
Bài học này trình bày nội dung: Liên kết ion - Tinh thể ion . Dựa vào cấu trúc SGK hóa học lớp 9, KhoaHoc sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.
A – KIẾN THỨC TRỌNG TÂM
Khái niệm liên kết: Trừ trường hợp các khí hiếm, ở điều kiện bình thường các nguyên tử của các nguyên tố không tồn tại ở trạng thái tự do, riêng rẽ mà liên kết với các nguyên tử khác nhau tạo thành phân tử hay tinh thể.
I. Sự hình thành ion, cation, anion
1. Ion, cation, anion
- Nguyên tử trung hòa về điện. Khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là ion.
- Trong các phản ứng hóa học, để đạt cấu hình bền của khí hiếm nguyên tử kim loại có khuynh hướng nhường electron cho nguyên tử các nguyên tố khác để trở thành ion dương , gọi là cation
VD: Na → Na+ + 1e
Mg → Mg2+ + 2e
- Trong các phản ứng hóa học, để đạt cấu hình bền của khí hiếm nguyên tử phi kim có khuynh hướng nhận electron cho nguyên tử các nguyên tố khác để trở thành ion âm , gọi là ation
VD: F + 1e → F-
O + 2e → O2-
2.Ion đơn nguyên tử và ion đa nguyên tử
- Ion đơn nguyên tử là các ion tạo nên từ một nguyên tử: VD: Li+, Na+ , S2-
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm. VD: NH4+, OH—
II.Sự tạo thành liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
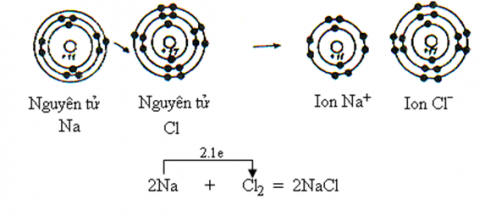
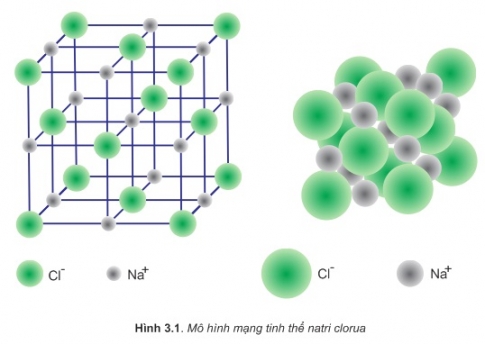
III. Tinh thể ion
- Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lơn. Các hợp chất ion đều khá rắn, khó bay hơi, khó nóng chảy
VD: Tinh thể NaCl
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Kiến thức thú vị
Câu 1.(Trang 59)
Liên kết hóa học trong NaCl được hình thành do:
A. hai hạt nhân nguyên tử hút electron rất mạnh.
B. mỗi nguyên tử Na và Cl góp chung 1 electron.
C. mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ + e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Câu 2.(Trang 59 SGK)
Muối ăn ở thể rắn là:
A. Các phân tử NaCl.
B. Các ion Na+ và Cl-.
C. Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Câu 3.(Trang 60 SGK)
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-)
b) Những điện tích ở ion Li+ , O2- do đâu mà có ?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm có cấu hình electron giống O2-
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti ?
Câu 4.(Trang 60 SGK)
Xác định số proton, nơtron, electron trong các nguyên tử oxi thu 2e.
a) ![]() , $_{18}^{40}\textrm{Ca}^{2+}$ , $_{17}^{35}\textrm{Cl}^{-}$ , $_{26}^{56}\textrm{Fe}^{2+}$.
, $_{18}^{40}\textrm{Ca}^{2+}$ , $_{17}^{35}\textrm{Cl}^{-}$ , $_{26}^{56}\textrm{Fe}^{2+}$.
b) ![]() , $_{16}^{32}\textrm{S}^{2-}$ , $_{13}^{27}\textrm{Al}^{3+}$.
, $_{16}^{32}\textrm{S}^{2-}$ , $_{13}^{27}\textrm{Al}^{3+}$.
Câu 5.(Trang 60 SGK)
So sánh số electron trong các cation sau : Na+, Mg2+, Al3+
Câu 6.(Trang 60)
Trong các hợp chất sau đây, chất nào chứa ion đa nguyên tử, kể tên các ion đa nguyên tử đó:
a) H3PO4
b)NH4NO3
c) KCl
d) K2SO4
e) NH4Cl
f) Ca(OH)2











