| TT | Công thức hóa học của axit | Số nguyên tử | Gốc axit |
| 1 | 1 | ||
| 2 | 2 | ||
| 3 | 2 | ||
| 4 | 3 |
Theo em, axit là hợp chất mà phân tử gồm có 1 hay nhiều nguyên tử hidro liên kết với gốc axit.
Soạn bài 7: Axit - sách được Khoahoc.com.vn sưu tầm và đăng tải. Tài liệu dưới đây sẽ giúp các em hướng dẫn trả lời và giải đáp các câu hỏi trong bài, với lời giải chi tiết, dễ hiểu sẽ giúp ích cho các em nắm chắc kiến thức. Dưới đây là nội dung tài liệu, các em tham khảo nhé
Hãy viết công thức hóa học của ba chất là axit mà em biết và cho biết thành phần phân tử của các axit đó (ghi theo bảng sau):
| TT | Công thức hóa học của axit | Số nguyên tử | Gốc axit |
| 1 | 1 | ||
| 2 | |||
| 3 | |||
| 4 |
Theo em, axit là gì?
| TT | Công thức hóa học của axit | Số nguyên tử | Gốc axit |
| 1 | 1 | ||
| 2 | 2 | ||
| 3 | 2 | ||
| 4 | 3 |
Theo em, axit là hợp chất mà phân tử gồm có 1 hay nhiều nguyên tử hidro liên kết với gốc axit.
I. Khái niệm, phân loại, gọi tên
1. Khái niệm
Chọn từ/ cụm từ thích hợp cho trong ngoặc đơn để điền vào chỗ trống, hoàn thành khái niệm axit:
(nhiều, hợp chất, đơn chất, hidro, một hay nhiều, oxi, một, gốc axit)
Axit là những ![]() mà phân tử gồm có ...(2)... nguyên tử ...(3)... liên kết với ...(4)..., các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại.
mà phân tử gồm có ...(2)... nguyên tử ...(3)... liên kết với ...(4)..., các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại.
Bài làm:
Axit là những hợp chất mà phân tử gồm có một hay nhiều nguyên tử hidro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại.
2. Phân loại
Dựa vào thành phần nguyên tử, các axit được chia thành những loại nào?
Bài làm:
Dựa vào thành phần phân tử, các axit được chia làm hai loại:
3. Gọi tên
Hãy gọi tên các axit sau: ![]()
Điền vào bảng sau:
| Axit | Tên axit | Gốc axit | Tên gốc axit | Hóa trị của gốc axit |
| axit sunfuro | sunfit | |||
| axit cacbonic |
| |||
| axit photphoric | photphat |
Bài làm:
![]() : axit bromhidric
: axit bromhidric
![]() : axit iothidric
: axit iothidric
![]() : axit flohidric
: axit flohidric
Điền vào bảng sau:
| Axit | Tên axit | Gốc axit | Tên gốc axit | Hóa trị của gốc axit |
| axit sunfuro | sunfit | II | ||
| axit cacbonic |
| cacbonat | II | |
| axit photphoric | photphat | III |
II. Tính chất hóa học của axit
1. Tính chất hóa học của axit
Thực hiện thí nghiệm sau và ghi các hiện tượng quan sát được theo bảng:
| Thí nghiệm | Cách tiến hành | Hiện tượng quan sát được |
| 1. Tác dụng của dung dịch axit với chất chỉ thị màu | Lấy một mẩu giấy quỳ tím để vào hõm của đế sứ, sau đó nhỏ 1 - 2 giọt dung dịch | |
| 2. Axit tác dụng với kim loại | Cho một mẩu kim loại ( | |
| 3. Axit tác dụng với bazo | Nhỏ từ từ dung dịch axit ( |
Viết PTHH của các phản ứng xảy ra.
Từ các thí nghiệm, nêu các tính chất hóa học chung của axit.
Bài làm:
| Thí nghiệm | Cách tiến hành | Hiện tượng quan sát được |
| 1. Tác dụng của dung dịch axit với chất chỉ thị màu | Lấy một mẩu giấy quỳ tím để vào hõm của đế sứ, sau đó nhỏ 1 - 2 giọt dung dịch | Giấy quỳ hóa đỏ. |
| 2. Axit tác dụng với kim loại | Cho một mẩu kim loại (Al/ Zn ...) vào ống nghiệm chứa 1 - 2 ml dung dịch axit ( | Mẩu kim loại tan ra, có khí thoát ra. PTHH: 2 |
| 3. Axit tác dụng với bazo | Nhỏ từ từ dung dịch axit ( |
PTHH: |
Tính chất hóa học của axit:
2. Axit mạnh, axit yếu
Nêu sự khác nhau về tính chất hóa học giữa axit mạnh và axit yếu.
III. Axit sunfuric (![]() )
)
1. Tính chất vật lí
2. Tính chất hóa học
a) Tính chất của dung dịch ![]() loãng
loãng
b) Một số tính chất hóa học riêng của ![]() đặc
đặc
Thực hiện các thí nghiệm sau và ghi các hiện tượng quan sát được theo bảng dưới đây:
| Thí nghiệm | Cách tiến hành | Hiện tượng quan sát được |
| 1. | Lấy hai ống nghiệm sạch, cho vào mỗi ống một mẩu lá đồng nhỏ. Nhỏ vào ống nghiệm thứ nhất 1 ml dung dịch | |
| 2. Tính háo nước của | Cho một ít vụn giấy lọc, hoặc một ít đường kính vào cốc thủy tinh (loại 100 ml). Thêm từ từ 1 - 2 ml |
1. Viết PTHH xảy ra giữa ![]() đặc nóng và Cu
đặc nóng và Cu
2. Em có nhận xét gì về khí thoát ra trong phản ứng giữa kim loại (như ![]() ) với các dung dịch axit thông thường (như
) với các dung dịch axit thông thường (như ![]() loãng ...) và trong phản ứng giữa kim loại Cu với
loãng ...) và trong phản ứng giữa kim loại Cu với ![]() đặc nóng.
đặc nóng.
3. Hãy dự đoán sản phẩm tạo thành ở thí nghiệm 2.
4. Hãy nêu sự khác nhau về tính chất hóa học giữa ![]() đặc và
đặc và ![]() loãng.
loãng.
| Thí nghiệm | Cách tiến hành | Hiện tượng quan sát được |
| 1. | Lấy hai ống nghiệm sạch, cho vào mỗi ống một mẩu lá đồng nhỏ. Nhỏ vào ống nghiệm thứ nhất 1 ml dung dịch | Cu trong ống nghiệm chứa axit đặc tan ra. PTHH: |
| 2. Tính háo nước của | Cho một ít vụn giấy lọc, hoặc một ít đường kính vào cốc thủy tinh (loại 100 ml). Thêm từ từ 1 - 2 ml | Xuất hiện chất rắn màu đen. |
Khí thoát ra trong hai trường hợp là khác nhau
Sự khác nhau về tính chất của ![]() đặc và
đặc và ![]() loãng:
loãng:
3. Ứng dụng
Quan sát hình vẽ và cho biêt các ứng dụng chủ yếu của axit sunfuric.
Các ứng dụng chủ yếu của axit sunfuric: dùng trong rất nhiều ngành công nghiệp
4. Sản xuất axit sunfuric
5. Nhận biết axit sunfuric và muối sunfat
Thực hiện các thí nghiệm sau và ghi các hiện tượng quan sát được theo bảng dưới đây
| Thí nghiệm | Cách tiến hành | Hiện tượng |
| 1 | Cho 1 - 2 ml dung dịch | |
| 2 | Cho 1 - 2 ml dung dịch |
| Thí nghiệm | Cách tiến hành | Hiện tượng |
| 1 | Cho 1 - 2 ml dung dịch | Xuất hiện kết tủa trắng. PTHH:
|
| 2 | Cho 1 - 2 ml dung dịch | Xuất hiện kết tủa trắng: PTHH:
|
Để nhận biết ![]() và muối sunfat, ta có thể sử dụng giấy quỳ tím, dung dịch nào làm quỳ tím hóa đỏ là axit.
và muối sunfat, ta có thể sử dụng giấy quỳ tím, dung dịch nào làm quỳ tím hóa đỏ là axit.
1. Viết PTHH xảy ra (nếu có) khi cho các chất: ![]() tác dụng với dung dịch H2SO4 loãng.
tác dụng với dung dịch H2SO4 loãng.
Bài làm: Các phản ứng hóa học xảy ra:
2. Hãy trình bày cách phân biệt các dung dịch riêng biệt (không nhãn) bằng phương pháp hóa học: ![]() loãng,
loãng, ![]() . Viết PTHH của các phản ứng xảy ra (nếu có).
. Viết PTHH của các phản ứng xảy ra (nếu có).
Bài làm:
| Thuốc thử | |||
| Quỳ tím | Giấy quỳ tím hóa đỏ | Giấy quỳ tím hóa đỏ | Giấy quỳ tím không đổi màu |
| Không có hiện tượng gì | Xuất hiện kết tủa trắng |
3. Hòa tan hết 1,6 gam ![]() trong dung dịch
trong dung dịch ![]() đặc (98%), đun nóng, thu được V ml khí
đặc (98%), đun nóng, thu được V ml khí ![]() (ở đktc). Tính V và khối lượng dung dịch
(ở đktc). Tính V và khối lượng dung dịch ![]() 98% đã tham gia phản ứng.
98% đã tham gia phản ứng.
Bài làm:
![]()
PTHH: ![]()
Theo phương trình hóa học, ![]()
Thể tích ![]() thu được là:
thu được là: ![]() lít.
lít.
Khối lượng ![]() cần dùng là:
cần dùng là: ![]() .
.
Khối lượng dung dịch ![]() 98% cần dùng là:
98% cần dùng là: ![]()
4. Viết các PTHH thực hiện dãy chuyển hóa sau (ghi rõ điều kiện phản ứng nếu có):
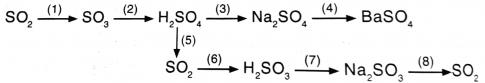
Bài làm:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Theo em, cần phải làm gì nếu bản thân hoặc người xung quanh mình không may bị bỏng axit?
Khi không may bị bỏng axit, ta cần:
Khoa học tự nhiên 8 bài 7: Axit được VnDoc chia sẻ trên đây. Hy vọng tài liệu này sẽ giúp ích cho các em có thêm tài liệu tham khảo, nắm chắc kiến thức cũng như áp dụng tốt các dạng bài tập về Axit. Chúc các em học tốt, nếu thấy tài liệu hay, hãy chia sẻ cho các bạn cùng tham khảo nhé