Đề thi thử THPT quốc gia môn Hóa Học năm 2017 Đề số 13
Bộ đề thi thử THPT Quốc gia dưới đây, chúng tôi sẽ cung cấp cho các bạn học sinh những hệ thống câu hỏi sát với chương trình thi năm nay theo quy định của Bộ GDĐT. Vì vậy, chỉ cần ôn luyện những bộ đề mà KhoaHoc cung cấp thì việc vượt qua kì thi sẽ không còn là mối lo ngại đối với các bạn.
ĐỀ THI THỬ THPT QUỐC GIA NĂM 2017
Môn: HÓA HỌC
(Thời gian làm bài: 50 phút, không kể thời gian phát đề)
Cho biết nguyên tử khối của các nguyên tố :
H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137.
Câu 1: Dung dịch chất nào sau đây làm quì tím hóa xanh?
A. Alanin.
B. Anilin.
C. Metylamin.
D. Glyxin.
Câu 2: Cho các hợp kim sau: Al – Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa học là
A. (2), (3) và (4).
B. (3) và (4).
C. (1), (2) và (3).
D. (2) và (3).
Câu 3: Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những chất nào sau đây?
A. Ca(HCO3)2, MgCl2.
B. Mg(HCO3)2, CaCl2.
C. Ca(HCO3)2, Mg(HCO3)2.
D. CaSO4, MgCl2.
Câu 4: Có các thí nghiệm sau
(a) Cho kim loại Na vào dung dịch CuSO4;
(b) Sục CO2 đến dư vào dung dịch Ca(OH)2;
(c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3;
(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3;
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 1
B. 4
C. 3
D. 2
Câu 5: Chất không có khả năng hòa tan được Cu(OH)2 là
A. axit axetic.
B. Ala-Ala-Gly.
C. glucozơ.
D. Phenol.
Câu 6: Dẫn 8,96 lít CO2 (ở đktc) vào 600 ml dung dịch Ca(OH)2 0,5M. Phản ứng kết thúc thu được m gam kết tủa. Gía trị của m là
A. 40
B. 30
C. 25
D. 20
Câu 7: Có 4 dd đựng trong 4 lọ hóa chất mất nhãn là (NH4)2SO4, K2SO4, NH4NO3, KOH, để nhận biết 4 chất lỏng trên, chỉ cần dùng dung dịch
A. BaCl2.
B. NaOH.
C. Ba(OH)2.
D. AgNO3
Câu 8: Hợp chất nào sau đây tác dụng được với vàng kim loại?
A. Không có chất nào.
B. Axit HNO3 đặc nóng.
C. Dung dịch H2SO4 đặc nóng.
D. Hỗn hợp axit HNO3 và HCl có tỉ lệ số mol 1:3.
Câu 9: Điện phân 200 ml dung dịch muối CuSO4 trong thời gian, thấy khối lượng dung dịch giảm 8 gam. Dung dịch sau điện phân cho tác dụng với dd H2S dư thu được 9,6g kết tủa đen. Nồng độ mol của dung dịch CuSO4 ban đầu là
A. 2M
B. 1,125M
C. 0,5M
D. 1M
Câu 10: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
A. Cu, Al2O3, Mg.
B. Cu, Al, MgO.
C. Cu, Al, Mg.
D. Cu, Al2O3, MgO
Câu 11: Cho dãy chuyển hoá sau: ![]() . X, Y, Z lần lượt là:
. X, Y, Z lần lượt là:
A. Cl2, Fe, HNO3.
B. Cl2, Cu, HNO3.
C. Cl2, Fe, AgNO3.
D. HCl, Cl2, AgNO3.
Câu 12: Chỉ dùng một thuốc thử duy nhất nào sau đây để phân biệt hai khí SO2 và CO2?
A. dd Ba(OH)2.
B. H2O.
C. dd Br2.
D. dd NaOH.
Câu 13: Hỗn hợp X gồm Fe và Cu, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là
A. 1,12
B. 3,36
C. 2,24
D. 4,48
Câu 14: Có 5 lọ đựng riêng biệt các khí sau: N2, NH3, Cl2, CO2, O2. Để xác định lọ đựng khí NH3 và Cl2 chỉ cần dùng thuốc thử duy nhất là
A. dung dịch BaCl2.
B. quì tím ẩm.
C. dd Ca(OH)2.
D. dung dịch HCl.
Câu 15: Cho dung dịch NaOH (dư) vào dung dịch chứa hỗn hợp FeCl2 và CrCl3, thu được kết tủa X. Nung X trong không khí đến khối lượng không đổi thu được chất rắn Y. Vậy Y là
A. Fe2O3.
B. CrO3.
C. FeO.
D. Fe2O3 và Cr2O3.
Câu 16: Đốt cháy hoàn toàn 8,96 lít (đktc) hỗn hợp M gồm 2 anken đồng đẳng liên tiếp X; Y (MX < MY) rồi dẫn toàn bộ sản phẩm cháy lần lượt qua bình I đựng P2O5 dư và bình II đựng dung dịch Ca(OH)2 dư thấy khối lượng bình I tăng m gam và khối lượng bình II tăng (m + 39) gam. Phần trăm thể tích anken Y trong M là
A. 80,00.
B. 75,00.
C. 33,33.
D. 40,00.
Câu 17: Hòa tan hoàn toàn 3,92 gam hỗn hợp X gồm Al, Na và Al2O3 vào nước (dư) thu được dung dịch Y và khí H2. Cho 0,06 mol HCl vào X thì thu được m gam kết tủa. Nếu cho 0,13 mol HCl vào X thì thu được (m – 0,78) gam kết tủa. Phần trăm khối lượng Na có trong X là
A. 44,01
B. 41,07
C. 46,94
D. 35,20
Câu 18: Cho từ từ đến dư dung dịch Ba(OH)2 vào các dung dịch sau:
(1) Dung dịch NaHCO3.
(2) Dung dịch Ca(HCO3)2.
(3) Dung dịch MgCl2.
(4) Dung dịch Na2SO4.
(5) Dung dịch Al2(SO4)3.
(6) Dung dịch FeCl3.
(7) Dung dịch ZnCl2.
(8) Dung dịch NH4HCO3.
Sau khi kết thúc các phản ứng, số trường hợp thu được kết tủa là
A. 6
B. 5
C. 8
D. 7
Câu 19: Cho 50,0 gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch HCl dư. Kết thúc phản ứng còn lại 20,4 gam chất rắn không tan. Phần trăm khối lượng của Cu trong hỗn hợp X là
A. 40,8
B. 53,6
C. 20,4
D. 40,0
Câu 20: Hỗn hợp X gồm C3H8, C2H4(OH)2 và một số ancol no, đơn chức, mạch hở (C3H8 và C2H4(OH)2 có số mol bằng nhau). Đốt cháy hoàn toàn 5,444 gam X rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thấy khối lượng bình tăng lên 16,58 gam và xuất hiện m gam kết tủa. Giá trị của m là
A. 47,477.
B. 43,931.
C. 42,158.
D. 45,704.
Câu 21: Hoà tan 5,6 gam Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Câu 22: Hai kim loại đều phản ứng với dung dịch Cu(NO3)2 giải phóng kim loại Cu là
A. Fe và Au.
B. Al và Ag.
C. Cr và Hg.
D. Al và Fe.
Câu 23: Cấu hình electron nào dưới đây được viết đúng?
Câu 24: Cho các kim loại: Ni, Fe, Cu, Zn; số kim loại tác dụng với dung dịch Pb(NO3)2 là
A. 4
B. 3
C. 2
D. 1
Câu 25: Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là:
A. II, III và IV.
B. I, III và IV.
C. I, II và III.
D. I, II và IV.
Câu 26: Tripeptit là hợp chất mà phân tử có
A. hai liên kết peptit, ba gốc β-aminoaxit.
B. hai liên kết peptit, ba gốc α-aminoaxit.
C. ba liên kết peptit, hai gốc α-aminoaxit.
D. ba liên kết peptit, ba gốc α-aminoaxit.
Câu 27: Trong hạt nhân nguyên tử, hạt mang điện là
A. proton và electron.
B. electron.
C. proton.
D. proton và notron.
Câu 28: Xenlulozơ có cấu tạo mạch không phân nhánh, mỗi gốc C6H10O5 có 3 nhóm -OH, nên có thể viết
A. [C6H7O3(OH)2]n.
B. [C6H5O2(OH)3]n.
C. [C6H7O2(OH)3]n.
D. [C6H8O2(OH)3]n.
Câu 29: Polime được điều chế bằng phản ứng trùng ngưng là
A. nilon-6,6.
B. polietilen.
C. poli(metyl metacrylat).
D. poli(vinyl clorua).
Câu 30: Xà phòng hóa hoàn toàn 2,96 gam HCOOC2H5 bằng một lượng dung dịch KOH vừa đủ. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
A. 3,36.
B. 2,52
C. 4,20
D. 2,72
Câu 31: Hòa tan hết 27,2 gam hỗn hợp rắn X gồm Fe3O4, Fe2O3 và Cu trong dung dịch chứa 0,9 mol HCl (dùng dư), thu được dung dịch Y có chứa 13,0 gam FeCl3. Tiến hành điện phân dung dịch Y bằng điện cực trơ đến khi ở catot bắt đầu có khí thoát ra thì dừng điện phân, thấy khối lượng dung dịch giảm 13,64 gam. Cho dung dịch AgNO3 dư vào dung dịch sau điện phân, kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất); đồng thời thu được m gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
A. 116,89.
B. 118,64.
C. 116,31.
D. 117,39.
Câu 32: Hỗn hợp E gồm este X đơn chức và axit cacboxylic Y hai chức (đều mạch hở, không no có một liên kết đôi C=C trong phân tử). Đốt cháy hoàn toàn một lượng E thu được 0,43 mol khí CO2 và 0,32 mol hơi nước. Mặt khác, thủy phân 46,6 gam E bằng 200 gam dung dịch NaOH 12% rồi cô cạn dung dịch thu được phần hơi Z có chứa chất hữu cơ T. Dẫn toàn bộ Z vào bình đựng Na, sau phản ứng khối lương bình tăng 188,85 gam đồng thời thoát ra 6,16 lít khí H2 (đktc). Biết tỉ khối của T so với H2 là 16. Phần trăm khối lượng của Y trong hỗn hợp E có giá trị gần nhất với giá trị nào sau đây?
A. 41,3%.
B. 43,5%
C. 48,0%.
D. 46,3%.
Câu 33: Thuỷ phân hoàn toàn m gam tetrapeptit X mạch hở thu được hỗn hợp Y gồm 2 amino axit (no, phân tử chứa 1 nhóm -COOH, 1 nhóm -NH2) là đồng đẳng kế tiếp. Đốt cháy hoàn toàn hỗn hợp Y cần vừa đủ 58,8 lít không khí (chứa 20% O2 về thể tích, còn lại là N2) thu được CO2, H2O và 49,28 lít N2 (các khí đo ở đktc). Số công thức cấu tạo thoả mãn của X là
A. 8
B. 12
C. 4
D. 6
Câu 34: Hỗn hợp X gồm glixerol, metan, ancol etylic và axit no, đơn chức mạch hở Y, trong đó số mol metan gấp hai lần số mol glixerol. Đốt cháy hết m gam X cần 6,832 lít O2 (đktc), thu được 6,944 lít CO2 (đktc).Nếu cho m gam hỗn hợp X tác dụng với 80 ml dung dịch NaOH 2,5M, rồi cô cạn dung dịch sau phản ứng thìthu được a gam chất rắn khan. Giá trị của a là
A. 10,88.
B. 14,72.
C. 12,48.
D. 13,12.
Câu 35: Hỗn hợp X gồm Al, Al2O3, Fe và các oxit của sắt trong đó O chiếm 18,49% về khối lượng. Hòa tan hết 12,98 gam X cần vừa đủ 627,5 ml dung dịch HNO3 1M thu được dung dịch Y và 0,448 lít hỗn hợp Z (đktc) gồm NO và N2 có tỉ lệ mol tương ứng là 1:1. Làm bay hơi dung dịch Y thu được m gam muối. Giá trị của m là
A. 60,272.
B. 51,242.
C. 46,888.
D. 62,124.
Câu 36: Điện phân hoàn toàn 200ml dung dịch AgNO3 với 2 điện cực trơ thu được một dung dịch có pH=2. Xem thể tích dung dịch thay đổi không đáng kể thì lượng Ag bám ở catot là
A. 0,540 gam.
B. 0,108 gam.
C. 0,216 gam.
D. 1,080 gam.
Câu 37: Có các dung dịch Al(NO3)3, NaNO3, Mg(NO3)2, H2SO4. Thuốc thử để phân biệt các dd đó là
A. dd BaCl2.
B. dd NaOH.
C. dd CH3COOAg.
D. qùi tím.
Câu 38: Nguyên liệu chính dùng để sản xuất nhôm là
A. quặng đôlômit
B. quặng boxit.
C. quặng manhetit.
D. quặng pirit.
Câu 39: Các nguyên tử thuộc nhóm IIA có cấu hình electron lớp ngoài cùng là
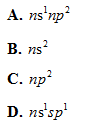
Câu 40: Cho 8,40 gam sắt vào 300 ml dung dịch AgNO3 1,3 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 16,20
B. 42,12
C. 32,40
D. 48,60
------------------- HẾT -------------------











